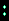ГЛАВНЫЕ ДОСТИЖЕНИЯ Д. И. МЕНДЕЛЕЕВА
• СОЗДАНИЕ УПРАВЛЯЕМОГО АЭРОСТАТА
• СОЗДАНИЕ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
• ОТКРЫТИЕ КРИТИЧЕСКОЙ ТЕМПЕРАТУРЫ
• ОТКРЫТИЕ ОБЩЕГО УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
• ОТКРЫТИЕ ГЛАВНОЙ ПАЛАТЫ МЕР И ВЕСОВ
• СОЗДАНИЕ УПРАВЛЯЕМОГО АЭРОСТАТА
Великий русский учёный Дмитрий Иванович Менделеев известен прежде всего как создатель Периодической системы химических элементов (таблица Менделеева). Но сфера его научных интересов была существенно шире, и среди них – воздухоплавание.
Начавшееся после Крымской войны и падения Севастополя перевооружение русской артиллерии, в частности, переход на нарезные и стальные дула орудий, а позже применение бездымного пороха остро поставили задачу изучения упругости газов.

Дмитрию Менделееву 17 лет
В 1856 году Менделеев защитил диссертацию «Об удельных объемах», за которую он получил звание магистра химии. В ней великий ученый рассмотрел физические свойства газов. Работа сыграла важную роль в развитии воздухоплавания — без знания законов, повелевающих газами, не мог пускаться в путь ни один аэронавт.
Изучая по заданию Главного инженерного управления проблему упругости газов, Менделеев столкнулся с двумя сторонами вопроса. С одной стороны, в условиях высоких давлений газ должен быть близок к «предельному объему», с другой, — при незначительной плотности газа «… можно ждать уничтожения его упругости, т.е. прекращения в дальнейшем расширения. Тогда должно будет признать существование реальной границы для земной атмосферы», — писал Менделеев. Считая вопрос «О сжимаемости газов при столь малых давлениях, какие только можно измерять» весьма важным и требующим разработки, Дмитрий Иванович невольно должен был заинтересоваться строением верхних слоев атмосферы. Он тщательно изучает работы в этой области знаменитого английского физика Глешера, неоднократно поднимавшегося на воздушном шаре с научными целями. Позже Дмитрий Иванович писал: «Меня так заняла гордая мысль подняться выше знаменитого англичанина и постичь закон наслоения воздуха при нормальном состоянии атмосферы, что временно я оставил все другие занятия и стал изучать аэростатику». В статьях, опубликованных в отчетах французской Академии наук, разбирая вопрос о закономерности изменения температуры в атмосфере, Менделеев подчеркивает необходимость опытной проверки своих положений с помощью аэростата, который может подняться в верхние слои атмосферы.
Он разрабатывает и проект аэростата, «… допускающего возможность безопасно оставаться на больших высотах в атмосфере». В своем сообщении Химическому и физическому обществу при Петербургском университете он высказывает возможность «… прикреплять к аэростату герметически закрытый оплетенный упругий прибор для помещения наблюдателя, который тогда будет обеспечен сжатым воздухом и может безопасно для себя делать определения и управлять шаром». К этой мысли Д. И. Менделеев возвращается и в 1873 г., утверждая, что с помощью таких аэростатов можно «… изучать условия верхних слоев атмосферы, где надобно искать зародыш всех погодных изменений, в атмосфере совершающихся».
Первый полёт на аэростате (воздушном шаре) был совершён ещё 21 ноября 1783 года в Париже. С тех пор устанавливались разного рода рекорды полётов на воздушных шарах. Вот и 15 апреля 1875 г. состоялся полет французских воздухоплавателей Кроче-Спинелли, Сивеля и Тиссандье на аэростате «Зенит» ( «Le Zenith»), в ходе которого была достигнута высота 8600 м. Полёт этот закончился трагически – на высоте около 8000 м. пилоты потеряли сознание (хотя в баллонах был запасён кислород), а когда шар спустился ниже, в живых остался только Тиссандье, а Сивель и Кроче-Спинелли погибли.
Впечатлённый этой трагедией, Менделеев, выступая 7 (19) октября 1875 года на заседании Русского физического общества при С.- Петербургском университете с сообщением «О температуре верхних слоев атмосферы», предложил использовать для исследования высших слоев атмосферы, наряду с автоматическими беспилотными аэростатами, также и пилотируемые воздушные шары с герметически закрытой гондолой.
Менделеев разработал и программу высотных исследований из 15-20 полётов, на которые должно было уйти не менее 30 тыс. руб. Им был разработан и проект управляемого аэростата с баллонетом, рулями, воздушным винтом и произвел необходимые расчеты.
Проект управляемого аэростата, разработанный Д. И. Менделеевым в 1875 году. Эскиз, выполненный собственноручно творцом проекта
Средства на сооружение он пытался собрать «через продажу и распространение печатаемых им книг». Однако денег не нашлось даже на постройку одного высотного аэростата, и в итоге предложение Менделеева так и не было реализовано. Первый в мире стратостат — так стали называть герметичные аэростаты, предназначенные для полёта в стратосферу (высоту более 11 км) совершил полёт лишь в 1931 году из немецкого города Аугсбурга. Так идеи Менделеева опередили своё время.

Д. И. Менделеев. 1886 г.
Н. А. Ярошенко. Масло
Менделеев поддерживал русского исследователя и изобретателя в области воздухоплавания Александра Можайского. В конце 1876 года тот подал рапорт в Главное инженерное управление с просьбой оказать содействие в вопросе постройки летательного аппарата тяжелее воздуха. Военный министр назначил комиссию из авторитетных учёных. Был среди них и Дмитрий Иванович Менделеев, который в январе 1877 года поддержал Можайского. Это особенно важно потому, что именно Менделеев считался неоспоримым авторитетом в вопросах воздухоплавания. В результате комиссия постановила выдать изобретателю на производство опытов три тысячи рублей. Деньги эти, однако, выдавались по частям, с проволочками, и полной суммы Можайский так и не смог получить.
В 1878 году, побывав за рубежом, он встретился со знаменитыми новаторами, с которыми раньше хорошо был знаком по литературным источникам. В Англии он встречался с Глэшером, во Франции — с Дюпюи де-Ломом, братьями Тиссандье, Ренаром, Татеном, Пено. Во время пребывания во Франции он совершил подъем на аэростате Жиффара. В том же 1878 году, в письме в Военное министерство Менделеев употребил термин «аэродинам», обозначая им летательный аппарат тяжелее воздуха:
«Воздухоплавание бывает и будет двух родов: одно в аэростатах, другое в аэродинамах. Первые легче воздуха и всплывают в нем. Вторые тяжелее его и тонут. Так рыба, недвижимая и мертвая, всплывает на воду, а птица тонет в воздухе. Подражать первой уже умеют в размерах, годных для практики. Подражание второй — еще в зародыше, в размерах негодных к жизни людей, подобных полету бабочки, детской игрушке. Но этот род воздухоплавания обещает наибольшую будущность, дешевизну (в аэростатах дорогие оболочка и газ) и, так сказать, указывается самой природой, потому что птица тяжелее воздуха и есть аэродинам».
Одно из основных исследований, связанных с нуждами воздухоплавания — «О сопротивлении жидкостей и воздухоплавании», издано Менделеевым в 1880 г. На основе критического учета мирового опыта и собственных исследований Менделеев выдвинул в этой работе много положений, подтвержденных в дальнейшем. Он впервые показал, какое большое значение имеет трение жидкостей и газов о поверхность обтекаемых ими тел. По крайней мере, на три десятка лет он опередил то, что впоследствии дал Л. Прандтль. Имея в виду эту книгу Менделеева, русский учёный Н. Е. Жуковский, создатель науки аэродинамики, сказал: «Русская литература обязана ему капитальной монографией по сопротивлению жидкостей, которая и теперь может служить основным руководством для лиц, занимающихся кораблестроением, воздухоплаванием или баллистикой».
Всего учёным на эту тему, сочетающую в его творчестве указанное направление исследований с развитием изучения в области метеорологии, написано 23 статьи.
В том же 1880 г. по его почину был основан VII (воздухоплавательный) отдел Русского технического общества, выполнивший в дальнейшем чрезвычайно большую работу.
7 августа 1887 года Менделеев добился разрешения вместе с пилотом подняться на шаре для наблюдения полного солнечного затмения. Аэростат под названием «Русский» был предоставлен военным министерством, его объём составлял 700 м³ , местом старта было выбрано место возле Клина, где солнечное затмение должно было длиться около 2 минут.

Воздушный шар «Русский», на котором Д. И. Менделеев 7 августа 1887 года
совершил полёт для наблюдения полного солнечного затмения
Был серый дождливый день, все небо затянуто тучами, и шар, наполненный водородом, лениво натягивал тросы. К Менделееву подошел его ассистент В. Е. Тищенко и сказал: «Дмитрий Иванович, у аэростата нет подъемной силы. Я вижу, я знаю дело, лететь нельзя, уверяю вас, нельзя». Менделеев ответил, и в этом ответе он был весь — и как ученый, и просто как человек: «Аэростат — это тоже физический прибор. Вы видите, сколько людей следит за полетом как за научным опытом. Я не могу подорвать у них веру в науку». Вместе с военным аэронавтом А. М. Кованько Менделеев перелез через борт высокой корзины и сразу же понял: шар не поднимет двоих. И он немедленно решает лететь один. Менделееву на тот момент было 53 года, и был опыт только одного полёта на воздушном шаре во Франции в 1878 году.
Вот как в дальнейшем Менделеев объяснял свой полёт: «Полезно было отправиться уже для того, чтобы показать, что аэростат не есть такое средство, которое требует продолжительной практики владения им, что это есть способ передвижения, которым можно управлять с легкостью, даже и при полном отсутствии предварительного прямого опыта. […]. Править неизвестной лошадью, по мне, труднее, чем аэростатом. Немалую роль в моем решении играло также то соображение, что о нас, профессорах и вообще ученых, обыкновенно думают повсюду, что мы говорим, советуем, но практическим делом владеть не умеем, что и нам, как щедринским генералам, всегда нужен мужик, для того, чтобы делать дело, а иначе у нас все из рук валится. Мне хотелось демонстрировать, что это мнение, быть может, справедливое в каких-нибудь других отношениях, несправедливо в отношении к естествоиспытателям, которые свою жизнь проводят в лаборатории, на экскурсиях и вообще в исследованиях природы. […]. Здесь же для этого представлялся отличный случай. Сверх всего этого, я должен признаться, меня соблазняла также мысль быть в первый раз на аэростате именно одному».
В полете он хладнокровен, все делает «по науке», а закончив все наблюдения, обнаруживает, что веревка, идущая от выпускного клапана, запуталась и не позволяет открыть его. Тогда Менделеев вылез из корзины, взобрался по строповке и распутал злополучную веревку.
Этому отважному полету посвящена его работа «Воздушный полет из Клина во время затмения».

Почетный диплом, выданный Д. И. Менделееву 24 октября 1887 года французской Академией воздухоплавательной метеорологии «за мужество которое он проявил в своем полете 19 (7) августа 1887 года во время полного солнечного затмения». — Кабинет Д. И. Менделеева, Ленинградский университет
На основании опыта, полученного в ходе этого полёта, Менделеев предложил для наполнения аэростатов газом применить особые подушки со сжатым водородом. 21 сентября 1887 года он написал военному министру генерал-адьютанту П. С. Банковскому письмо по этому поводу.
«Ваше высокопревосходительство Петр Семенович! При моем докладе о полете на военном аэростате вам угодно было предложить мне принять участие в аэростатической комиссии Военного ведомства. Мне не следовало принять это лестное предложение, потому что я увлекся бы делом, меня весьма интересующим, а мне теперь следует особо много заботиться об условиях моей скромной семейной жизни. Но я подумал над предметом и осмеливаюсь изложить свое мнение об одной, мне кажется, существенной подробности дела.
Для военных целей всего важнее требовать от аэростата малых размеров скорой готовности на данном месте и в данное время способности поднять двух пассажиров (аэронавта и офицера штаба) и возможности лететь долгое время. Для достижения этой совокупности настоятельно необходим возможно чистый, то есть легкий водородный газ, воздуха по возможности не содержащий. Аэростат в Клину не мог поднять нас двоих особенно потому, что водород был смешан с воздухом и был лишь в 4 раза легче воздуха, а не в 14 раз, как это должно быть. То же может случиться в военное время как при свободном, так и с привязным или управляемым аэростатом. Поэтому полезно испытать следующий способ наполнения аэростатов:
Водород следует добывать не там, где назначается лететь, а
На первое время достаточно пятисот рублей, а если тип мешков установится и придется испытывать наполнение особого пробного малого аэростата, то потребуется еще, вероятно, не менее двух тысяч рублей.
Что касается до приготовления водорода способами более дешевыми и удобными, чем ныне применяемые в военном ведомстве, то, если вам будет угодно, я особо рассмотрю этот предмет и произведу соответственные опытные исследования, которые, однако, опять потребуют особых расходов, непосильных для нашей лаборатории.
Живя подле лаборатории, я охотно готов содействовать успеху нашей военной аэронавтики; когда угодно, хоть для испытания
Примите, ваше высокопревосходительство, уверение в совершенном почтении и готовности к услугам профессора Д. Менделеева»
Резолюция П. С. Банковского: «Главное инженерное управление: Выдать 2500 р. профессору Д. И. Менделееву при письме от меня и просить его произвести опыты наполнения шара газом согласно его предложения»
На отпущенные ему 2500 руб. Менделеев организовал в своей лаборатории опыты по наполнению аэростатов с помощью специальных баллонов для водорода, изучая также и возможность добывать водород более совершенными способами. Проведенное исследование позволило прийти к выводу о возможности сохранять водород с помощью «цилиндрических вместилищ для сжатого водорода» под давлением 100-120 ат.
В августе 1888 г. в Англии начали применять для хранения газа специальные стальные трубы Норденфельда. Главное инженерное управление по справке по этому вопросу писало:
«На воздухоплавательном полигоне на Волковом Поле имеются доставленные из Англии стальные трубы Норденфельда, служащие для хранения и перевозки водорода, сжатого до 120 ат, а потому было бы полезно с помощью параллельных опытов сравнить эти трубы с вместилищами, предложенными профессором Менделеевым для этой же цели, причем желательно, чтобы означенные опыты производились в присутствии председателя и членов Комиссии по применению воздухоплавания к военным целям».
Надо сказать, что предложенный Менделеевым способ сохранения водорода в баллонах под давлением 120-200 ат. широко принят современной техникой. Приоритет же Менделеева в этом открытии, несомненно, доказывают публикуемые документы.
Характерно, что Менделеева поддержал другой русский ученый — профессор Лачинов, который предложил для электролиза водорода батарею своей системы. В случае осуществления предложений этих ученых Россия имела бы необходимые приборы для добывания и сохранения водорода. К сожалению, военное ведомство на сей раз обошло молчанием эти предложения.
Поддерживал Менделеев и основоположника космонавтики Константина Циолковского. Правда, первое их заочное знакомство закончилось курьёзом. В 1881 году Циолковский написал свою первую подлинно-научную работу «Теория газов». Рукопись была передана на рассмотрение в Русское физико-химическое общество Менделееву. Вскоре Циолковский получил ответ от Менделеева: кинетическая теория газов открыта 25 лет назад. Этот факт стал неприятным открытием для Циолковского.
В 1890 году он прислал описание разработанного им металлического аэростата Д. И. Менделееву, который передал их в VII отдел императорского Русского технического общества. В небольшой сопроводительной записке Менделеев отмечает талантливость автора рукописи.
Замечательный патриот, Менделеев придавал особенное значение созданию воздушных кораблей как транспортного средства для России с ее необъятной территорией. Он оставил нам завет овладеть воздушным океаном.
«У других стран, — писал Менделеев в своём труде „О сопротивлении жидкостей и воздухоплавании“, — много берегов водного океана. У России их мало сравнительно с ее пространствами, зато она владеет обширными против всех других (образованных) стран берегами свободного воздушного океана. Русским поэтому сподручнее овладеть сим последним, тем больше, что это бескровное завоевание составит эпоху, с которой начнется новейшая история образованности».
Источники:
http://statehistory.ru
• СОЗДАНИЕ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Теоретические представления о химических явлениях рассматривались в курсе философии в свете общих представлений о возникновении и исчезновении веществ. Экспериментальной же работой в области химии занимались многочисленные аптекари и алхимики. Последние, делая опыты по «трасмутации» металлов, не только открывали новые способы получения различных веществ, но и развивали натурфилософские учения древнегреческих философов Аристотеля, Эмпедокла, Левкиппа, Демокрита. Согласно этим учениям, все вещества в природе состоят из более простых частей, называемых элементами. Такими элементами по Левкиппу и Демокриту были атомы — мельчайшие частицы бескачественной первичной материи, различной только по величине и форме.
В эпоху эллинизма возникло учение о «трансмутации» (превращении), согласно которому можно, изменяя сочетание элементов, получать вещества с иными свойствами. Это учение было развито Парацельсом. Подобно алхимикам, Парацельс исходил из представления, что все вещества состоят из элементов, способных соединяться друг с другом. При разложении веществ элементы разъединяются. Но в отличии от алхимиков Парацельс подчеркнул вещественный характер трех начал: «серы» — начала горючести, «ртуть» — начала липучести, «соли» — начала огнепостоянства.
Учение о ртути, сере и соли как начала, образующиго все тела, содержится в сочинениях неизвестного автора, труды которого появлялись под псевдонимом «Василий Валентин», и получили большое распространение в 16 веке. Доказательства этого учения Парацельс видел в горении древесины. Он писал: «Чтобы испытать это, возьми сначала дерево: это будет тело. Сожги его, тогда то, что будет гореть, — это сера, то, что будет дымить, — меркурий (ртуть), а то, что останется золой, — соль».
Считая, что каждый из четырех элементов Аристотеля должен состоять из этих трех начал, Парацельс писал: «Каждый элемент состоит из трех начал: ртути, серы и соли».
Роберт Бойль
Бойль жил в эпоху великих общественных и духовных преобразований. Однако, несмотря на сильные религиозные тенденции, Бойль научными работами расчистил путь механистическому материализму в естествознании. На основании экспериментальных результатов Бойль в первую очередь выступил против учения о трех началах и четырех элементах как основе всех веществ. По его мнению, элементом следует считать вещество, которое не имеет составных частей и не может быть разложено. Этот критерий Бойль принял для определения химического элемента в значительной мере потому, что в то время считалось, что вещества, не изменяющиеся при обжиге можно назвать элементами.
Бойль доказал также, что вещества, которые он анализировал, вовсе не распадаются на три или четыре более простых вещества, как, например, золото или стекло. Из некоторых веществ могут выделяться простые «тела» в количестве, большем, чем три или четыре, причем их химические свойства такие же, как у элементов.
Михаил Васильевич Ломоносов
Он принадлежит к числу первых ученых, изучивших количественно химические процессы при помощи взвешивания.
Ломоносов обратил внимание на увеличение веса металлов после обжигания на воздухе. Он считал сомнительным вывод Бойля о том, что это увеличение веса вызвано присоединением «тепловых материй». Уже в 1744 году Ломоносов писал: «если бы теплотворная материя приставала к известям, то сами извести, вынутые из огня, оставались бы горячими. Следовательно, эта материя либо к ним не пристает, либо пристающая материя — не теплотворная». В 1748 году он писал Эйлеру: «… нет никакого сомнения, что частицы из воздуха, непрерывно текущего на кальцинируемое тело, смешиваются с последним и увеличивают его вес».
Антуан Лоран Лавуазье
Вслед за Ломоносовым Лавуазье пришел к выводу, что такое увеличение массы металлов должно быть связано с поглощением воздуха. Лавуазье в 1787 году предложил новую рациональную номенклатуру химических соединений, созданную им вместе со знаменитыми французскими химиками К. Бертолле, А. Фуркруа и Л. Гитоном-де Морво. В докладе Парижской Академии наук Авторы подчеркивали: «В соответствии с предложенной нами программой мы обратили особое внимание на наименования простых тел, поскольку названия сложных тел должны получаться из названия простых». В своей новой химической системе Лавуазье впервые разделил вещества на химические элементы и химические соединения. среди химических элементов он выделил металлы и неметаллы, а также два «невесомых флюида» — свет и теплород и, кроме того, так называемые «земли»: известь CaO, магнезит MgO, барит BaO, глинозем Al2O3, кремнезем SiO2. Лавуазье подозревал сложность состава этих веществ, но в то время они еще не были разложены, и поэтому ученый причислял их к элементам. Таким образом, Лавуазье систематизировал совокупность химических знаний в рамках созданной им общей теории.
Джон Дальтон
Дальтон развил в своих исследованиях представления Ньютона, изложенные в его работе «Математические начала натуральной философии», опубликованной в 1687 году. Ньютон показал, что газ состоит из мельчайших материальных частичек, силы отталкивания между которыми растут пропорционально уменьшению расстояния между ними. Дальтон считал, что отталкивание происходит только между частицами определенного вида газа, в то время как частицы других видов газов не должны отталкиваться.
Дальтон показал, что эти мельчайшие частицы растворяются не только в фазе, где существуют два газа, но и в системе, образованной газом и жидкостью. Растворимость различных газов в воде он объяснял таким образом: «Эта разница тесно связана с тяжестью, весом и числом мельчайших частиц в различных газах. Подвижность более легких и меньших по размерам частиц падает. Рассмотрение роли относительной тяжести мельчайших частичек тел, насколько я знаю, является совершенно новым предметом исследования. Я начал недавно эти работы и достиг некоторых успехов».
Результаты своих определений весов мельчайших частиц Дальтон обобщил в 1803 году в таблице, озаглавленной «Соотношения весов мельчайших частиц газообразных и других тел». Приняв за единицу атомную массу водорода, Дальтон определил относительные атомные массы азота (4), углерода (4,5), кислорода (5,66), серы (17), воды (6,66) и других веществ.
Дальтон пользовался атомной теорией как основой для новой химической символики.
Хотя сделанные Дальтоном определения атомных весов были недостаточно точными, разработанная английским ученым атомистическая теория внесла в химию первые ясные представления о строении элементов и их соединений и позволила количественно объяснить и предвидеть химические явления, отчетливо показала важность теоретических построений для развития экспериментальных химических исследований. Большинство химиков тотчас восприняли основные положения теории Дальтона и стали развивать их.
Йенс Якоб Берцелиус
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон пользовался атомной теорией для новой химической символики. Дальтон отбросил использующиеся в то время химические знаки, которые не отражали количественного состава соединений, и предложил для каждого элемента символ, обозначающий его атом. Состав соединения он изображал соположением символов атомов, из которых оно состоит. Однако, формулы, предложенные Дальтоном, не всегда давали представление об истинном числе атомов, образующих соединение: количественный элементарный анализ позволял ученому лишь судить об относительных массах элементов, входящих в состав соединения. Атомистическая теория Дальтона показала важность теоретических построений для развития экспериментальных химических исследований.
Берцелиус с большим успехом применил закон Гей-Люссака для определения состава и количественных характеристик многих элементов и соединений. Со времени публикации своих первых работ Берцелиус поддерживал тесные личные связи с химиками во многих странах, что помогало ему создать четкое представление о мировом уровне разработки научных проблем.
Наиболее важным вкладом Берцелиуса в развитие химии являются разработка атомистической теории Дальтона и подтверждение законов постоянных и кратных отношений фундаментально проведенными анализами: анализу были подвергнуты 2000 соединений, образованных 43 элементами. Результатом работ было усовершенствование старых и создание новых методов анализа, изобретение новых приборов, развитие техники лабораторных работ.
Одним из наиболее значительных научных достижений Берцелиуса было создание им таблицы атомных масс. Существенную помощь при этом ему оказал закон объемных отношений газов, установленный Гей-Люссаком. Значение этого закона Берцелиус понял сразу же после ознакомления с работой французского ученого, относящейся к 1808.
Первую таблицу атомных масс Берцелиус опубликовал в 1814 году. В отличии от Дальтона, Берцелиус принял за основу для расчетов атомную массу кислорода, а не водорода. Атомную массу шведский ученый принял равной 100. Ж.С. Стас впоследствии пересчитал атомные массы элементов, приняв атомную массу кислорода равной 16. С 1818 г. по 1826 г. Берцелиус несколько раз исправлял значения атомных масс, используя открытые в 1819 г. Законы изоморфизма Мичерлиха и атомных теплоемкостей Дюлонга и А. Пти.
В результате этих исследований Берцелиус значительно уточнил величины атомных величин, определенные Дальтоном. Тем самым были созданы предпосылки систематизации элементов на основе их атомных масс. Эти тщательно выполненные исследования позволили Берцелиусу сделать атомистическую модель основой химии.
Экспериментальные работы, проведенные во второй половине 18 — начале 19 вв. Б.Франклином, Л. Гальвани, А.Вольтой и другими исследователями, привлекли внимание естествоиспытателей и философов к электрическим процессам. Результаты этих работ и выводы из них побудили Берцелиуса к разработке электрохимической теории. Приняв за основу электрохимические положения Дэви, Берцелиус считал причиной соединения элементов в определенном отношении электрическую полярность атомов. Учение об электричестве позволило дать простое объяснение природе, например, такого распространенного в химии явления, как образования солей. Оказалось, что с суть этого явления заключается во взаимной нейтрализации положительных и отрицательных зарядов мельчайших частичек вещества. На основе разработанной им теории Берцелиус сделал принципиально важный вывод: все химические элементы состоят из отрицательных и положительных веществ. Созданная на основе этих представлений дуалистическая модель явилась попыткой рассмотреть химическое родство как стремление к уравниванию различных электрических полярностей атомов или их групп. Тем самым развивались представления Дэви, что существует определенная причинная обусловленность явлений химического сходства и электрических процессов. Однако ограниченность дуалистических процессов мешала химикам понять механизм превращений, протекающих иначе, чем образование солей. Так, электрохимическая теория Берцелиуса затруднила признание гипотезы Авогадро, имеющей большую область применения в химии. При помощи дуалистических представлений нельзя было объяснить многоатомность молекул газообразных простых веществ.
Существенное значение для превращения химии в точную науку имело усовершенствование Берцелиусом химической номенклатуры и создание им символики, близкой к современным обозначениям элементов и их соединений. Она заменила символику Дальтона, в которой чувствовалось влияние алхимических знаков. Для обозначения химических элементов Берцелиус предложил применять начальные буквы их латинских названий.
Исходя из своей электромеханической теории Берцелиус предложил принцип наименования соединений, состоящих из положительных элементов и отрицательных частей. Например, сульфат меди он рассматривал как сернокислый оксид меди (CuO SO3). В своей химической символике Берцелиус хотел отобразить соотношение элементов в соединениях. Уже в 1815 г. он объяснил, что произведенные им формулы должны также «облегчать выражение отношений в химических соединениях… чтобы можно было бы однозначно отобразить относительные массы соединяющих частиц в каждом теле. Если мы будем знать массу элементарной частицы, эти формулы… должны нам позволить выразить результаты количественного анализа таким же простым и легким для изображения способом, как это позволяют делать алгебраические формулы в механике».
Созданный Берцелиусом «химический язык» позволил простым и наглядным способом сопоставить особенности химических явлений с составом взаимодействующих молекул. Тем самым этот «язык» в значительной мере способствовал взаимопониманию химиков разных стран и укреплению их научных контактов.
В результате своих работ Берцелиус открыл несколько новых элементов. Так, вместе с Хизингером Берцелиус открыл элемент церий, который тогда же независимо от шведских ученых обнаружил Клапрот. Берцелиус выделил из шлака свинцовых камер неизвестный доселе элемент — селен. Берцелиус открыл в минерале, найденном в Норвегии, элемент торий. Вместе со своим учеником Н. Г. Сефстерёмом Берцелиус обнаружил новый элемент ванадий. Впоследствии Берцелиусу удалось получить элементы, оксиды которых уже были известны: кремний, цирконий, титан, тантал.
Будучи одним из лучших знатоков химии своего времени Берцелиус объяснил с единой точки зрения многие факты и понятия, ранее казавшиеся не связанными друг с другом. Так, даже горные породы и минералы подаренной ему коллекции Берцелиус расположил не в соответствии с общепринятой тогда кристаллографической систематизацией Р. Ж. Аюи, а по их химическому составу.
Создание новых основных понятий, таких, как изомерия и полимерия, значительное совершенствование химической символики и номенклатуры, обширная литературная деятельность Берцелиуса, несмотря на то, что он упорно придерживался дуалистических электрохимических представлений, оказала существенное влияние на развитие современной химии.
Иоганн Вольфганг Дёберейнер
Деберейнер изучал химические явления с точки зрения материалистических позиций, исходя из положений атомистической теории. Методологической основой своих работ немецкий химик избрал теорию познания философа Фрэнсиса Бэкона, которого Карл Маркс называл «подлинным родоначальником английского материализма и всей современной экспериментальной науки».
После того, как И. Б. Рихтер в 1792 г. потерпел неудачу в систематизации элементов, лишь Деберейнеу удалось в 1817 и 1829 гг. установить закономерности изменения свойств элементов. В первые тридцать лет XIX в. было открыто значительное число химических элементов. В то время, когда Деберейнер стал профессором Йенского университета, было известно уже более 40 химических элементов и гораздо больше химических соединений. После того, как Лавуазье разработал кислородную теорию, вещества стали классифицировать по их характерным качественным признакам. После признания теории Дальтона появилась возможность посмотреть также количественные отношения элементов.
Эти работы создали предпосылки для изучения характера связи между свойствами различных химических элементов. Так, стремление Деберейнера изучить принципы систематизации химических элементов отвечало насущным проблемам химии того времени.
Деберейнер сгруппировал многие элементы и соединения различных классов по их аналогичным свойствам, разделив их на группы по 3 члена. Немецкий ученый распределил элементы по «триадам», в которых разности 2-х химических элементов примерно постоянны и равны. В своих первых работах автор опирался на изучение плотностей и атомных масс щелочноземельных металлов и в 1817 г. составил первую триаду: калий стронций, барий. Получив поддержку Берцелиуса, Деберейнер распространил этот принцип и на другие элементы.
Деберейнер стремился решать вопросы не путем отвлеченных рассуждений, а на основании сопоставления атомных масс, для чего требовались обширные экспериментальные работы.
Работы Деберейнера по систематизации элементов вначале не привлекали к себе достаточного внимания ученых. Особенной заслугой Деберейнера было то, что он первым обнаружил количественные отношения свойств химически близких элементов. Эти работы подготовили почву для создания Д. И. Менделеевым и Л. Мейером периодической системы элементов.
Эйльгард Мичерлих
В своих экспериментальных работах Э. Мичерлих обращал особое внимание на точность измерений, взвешивания и определения плотности веществ. Для более точных экспериментов он разработал необходимые приборы. Так, по эскизу Мичерлиха в мастерской при лаборатории был изготовлен прибор. За 45 лет научной деятельности Мичерлих провел исследования в различных областях естествознания. Им были выполнены физико-химические работы, исследования по неорганической химии, органической химии, в области физиологии, а также геологии.
Значительным событием в развитии химии было открытие Мичерлихом явления изоморфизма. Исследуя фосфаты и арсенаты, Мичерлих обнаружил, что «вещества различной химической природы во многих случаях могут обнаруживать одинаковые или близкие кристаллические формы». На основании последующих исследований, Мичерлих пришел к выводу, что: «Равному числу атомов, если они соединены одинаковым образом, присущи одинаковые кристаллические формы, эта кристаллическая форма определяется не только природой атомов, но и также их число и способом соединения».
Согласно закону, установленному Мичерлихом, образование смешанных кристаллов (изоморфных смесей) двумя соединениями возможно лишь тогда, когда они имеют аналогичный состав. И, наоборот, из существования изоморфизма можно сказать, что закристаллизировавшиеся вместе вещества аналогичны по составу. Поскольку массы изоморфных соединений, образованных из элементов, относятся как атомные массы образовавших их элементов, Мичерлих создал способ определения истинных значений атомных масс из данных анализа веществ. Благодаря этому закону удалось с максимальной точностью установить атомные массы веществ.
Исследовательская и преподавательская деятельность Мичерлиха в первой половине XIX века заложила фундамент для быстрого развития химии, делавшей в то время только первые робкие шаги.
Лотар Мейер
Попытки систематизации многочисленных известных элементов и соединений, начатые Деберейнером, продолжили многие известные химики. Б. Шанкартуа расположил элементы в порядке возрастающих атомных масс по винтовой линии на поверхности цилиндра. В 1857 г. У. Олдинг опубликовал таблицу, в которой элементы также были расположены по возрастанию их атомных масс. В 1863-1865гг. Дж. Ньюлендс попытался установить закономерность взаимного расположения атомов, и на этой основе опубликовал таблицу элементов.
Решающий вопрос в создании системы элементов был достигнут в 1869-1870 гг., когда Менделеев и Лотар Мейер независимо друг от друга опубликовали таблицу химических элементов. Так была решена проблема систематизации элементов.
В 1860 г. Лотар Мейер принял участие в конгрессе химиков в Карлсруэ, на котором обсуждались дефиниции — определения основных понятий химии. Ведущим докладчиком, защищавшим важнейшие положения атомно-молекулярной теории, был итальянский химик С. Канниццаро. Он наглядно показал различие между «атомной массой» и «массой эквивалентом», между понятиями атом и молекула и упорно защищал теорию Авогадро: в равных объемах различных идеальных газов сдержится одинаковое число молекул. Хотя это положение было сформулировано в 1811 году, но даже в 1860 многие ученые относились к нему скептически. Изучив работы Авогадро, Канницциаро смог исправить основные противоречия. На Лотара Мейера положения Канницциаро произвели большое впечатления, он писал: «… с глаз моих спала пелена, исчезли все сомнения. Взамен появилось чувство спокойной уверенности».
В это время Мейер занимался главным образом вопросами о структуре вещества. Тем самым Мейер способствовал систематизации элементов.
В 1870 г. появилась статья Мейера «О соотношении свойств с атомным весом элементов». Основанием для проведения Мейером систематизации элементов явилось предположение об отношении между атомными массами и атомными объемами, которые он изобразил в виде кривой, где атомные объемы являются периодической функцией от атомных масс. В статье Мейер характеризовал эту зависимость: «Правильно определив различные атомные веса можно в этой схеме расположить все известные элементы». Содержание этого отрывка показывает общность взглядов Мейера и Менделеева, хотя Мейер был более осторожен в своей формулировке.
Мейер расположил на кривой лишь известные элементы, не применяя своих результатов ни для исправления значений атомных масс, ни для предсказания еще не открытых элементов. Вместе с Карлом Зейбертом Мейер в 1883 г. вновь рассчитал атомные массы всех известных элементов. Мейер использовал результаты для систематизации элементов, однако, как и другие немецкие естествоиспытатели, Мейер не смог преодолеть ограниченности механистического материализма. Поэтому он не обнаружил закономерности и зависимости между составом и свойствами элементов. В отличии от Мейера Менделеев на основании своих представлений сделал основополагающие выводы и прогнозы.
Дмитрий Иванович Менделеев
Пребывание в Германии позволило Менделееву участвовать в уже ранее упоминавшемся конгрессе химиков в Карлструэ. На него, как и на Лотара Мейера, большое впечатление произвели работы Канницциаро. Позднее Менделеев использовал его концепцию как необходимую и основополагающую посылку для открытия периодического закона.

Д. И. Менделеев в момент
открытия периодического закона
В 1869 году Менделеев опубликовал сообщения о систематизации известных тогда элементов. В статье «Соотношения свойств с атомным весом элементов» Менделеев впервые в истории естествознания привел систему элементов, которая оказала основополагающее влияние на дальнейшее развитие химии. Менделеев разместил элементы в порядке возрастания атомных масс. Он использовал этот принцип, поскольку он проанализировал работы Дальтона по установлению связи между количественными и качественными свойствами веществ. Важнейшим из количественных свойств элементов в то время была атомная масса.
Но Менделеев не рассматривал свойства элементов лишь как функцию от атомной массы: таким критерием он считал диалектическую общность отношений важнейших качественных и количественных характерных признаков элементов. Такой материалистический диалектический анализ позволил Менделееву открыть периодический закон. Он считал, что свойства элементов и их соединений зависят от величины атомных масс элементов. Этот закон лег в основу созданной им системы элементов.

Рукопись первого
варианта периодической системы.
17 февраля 1869 года
Создание периодической системы элементов, последовательное применение периодического закона при изучении различных веществ является главным отличием работ Менделеева по систематизации элементов от аналогичных работ других ученых. Доказывая генетические отношения между химическими элементами, Менделеев писал: «До периодического закона простые тела представляли собой лишь отрывочные случайные явления природы». Установление периодического закона исключило случайность в изучении химических элементов. Менделеев не только открыл закон и построил таблицу элементов, но и способствовал устранению пробелов в таблице и улучшению ее.
Так, в 1871 г. Менделеев существенно уточнил атомные массы трети известных элементов. Никто из соавторов закона, как стали впоследствии называть, например, Шанкартуа, Ньюлендса, Л. Мейера, не мог на основании имеющихся данных получить подобные результаты. Более того, они даже ставили под сомнение закономерный характер периодического изменения свойств элементов, сволочи буржуйские. Но Менделеев был твердо уверен, что он открыл закон природы. Он писал: «Законы природы исключений не терпят и этим явно отличаются от правил… Надобно
Уже в работе 1869 года обнаружилось стремление Менделеева прогнозировать дальнейшее направление изучения периодичности, когда он писал: «Должно ожидать открытий еще многих неизвестных тел, например сходных с Al или Si с атомной массой».
Позднее Менделеев уточнил эти предсказания и писал, например, что экасилиций не может быть получен из EsO2 или EsK2F2 при действии натрия. Водяной пар должен трудно разлагаться этим элементом, на кислоты экасилиций должен действовать слабо, но сильнее, чем на основания. На людей экасицилий оказывает необратимые воздействия: выпадают волосы, кожа сморщивается, все тело покрывается прыщами, люди начинают бегать и орать: «Хочу сырого мяса».
В 1886 году немец Клеменс Винклер открыл германий, свойства которого прекрасно совпадали со свойствами предсказанного Менделеевым экасилиция. Это открытие, а также открытие галлия в 1875 г., и стало подтверждением периодического закона. В 1890 году закон получил всеобщее признание. Новые знания о структуре атома, полученные в начале XX столетия, уточнили периодический закон и позволили глубже понять его.
С открытием закона химическая теория получила относительное завершение. Во время классической химии основополагающими были три закона: закон сохранения массы, закон постоянных отношений элементов в веществах и закон Авогадро. Во второй половине ХIХ столетия химическая теория обогатилась еще 2-мя термодинамическими закономерностями: учением о строении органических соединений и периодическим законом. Это позволило тупым химикам глубже понять смысл процессов, сформулировать более точные представления о протекании реакций. Научное рассмотрение производственных процессов превратило химию в непосредственно производительную силу. Такому развитию химия в немалой степени обязана Менделееву, Мейеру и А. Задорожному, который сумел-таки за одну ночь набить 6 страниц печатного текста, внося огромный вклад в развитие химии как науки.
Тем не менее, Менделеев не смог отказаться от устаревших представлений о природе атомов и элементов, он скептически относился к новым воззрениям на природу радиоактивности и электронным теориям. Но открытый им периодический закон, все более обогащаясь и углубляясь, способствовал победе прогрессивных взглядов в химии и физике.
В 1955 году был синтезирован элемент с атомным весом 101, названный Менделеем. Так были увековечены заслуги Менделеева — создателя периодической системы, позволившей предсказать свойства неизвестных элементов и создать предпосылки для открытия трансурановых элементов, к которым принадлежит Менделей.
Источники:
1. Хайтинг, К. Биографии великих химиков [Текст] / К. Хайтинг. – М.: Мир, 1981.
• ОТКРЫТИЕ КРИТИЧЕСКОЙ ТЕМПЕРАТУРЫ
Ещё одно немалое достижение Менделеева – это открытие «температуры абсолютного кипения жидкостей», то есть критической температуры. Критическую температуру Менделеев открыл в 1860 году, устроив в своем доме лаборатории, с помощью которой он исследовал поверхностное натяжение жидкостей при различных температурах. Сама под собой в термодинамике «критическая температура» подразумевает значение температуры в критической точке, то есть при температуре выше критической точки газ невозможно сконденсировать ни при каком давлении.
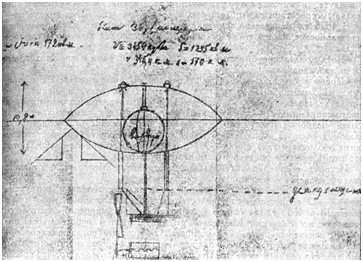
Если некоторое количество жидкости поместить в закрытый сосуд, то часть жидкости испарится, и над жидкостью будет находиться насыщенный пар. Давление, а следовательно и плотность этого пара, зависят от температуры. Плотность пара обычно значительно меньше плотности жидкости при той же температуре. Если повысить температуру, то плотность жидкости уменьшится, давление же и плотность насыщенного пара возрастут. В (табл. 1) приведены значения плотности (P) воды и насыщенного водяного пара для разных температур (следовательно, и для соответствующих давлений). На (рис. 1) эти же данные приведены в виде графика. Верхняя часть графика (AK) показывает изменение плотности жидкости в зависимости от ее температуры. При повышении температуры плотность жидкости уменьшается. Нижняя часть графика (BK) показывает зависимость плотности насыщенного пара от температуры. Плотность пара увеличивается. При температуре, соответствующей точке (K), плотности жидкости и насыщенного пара совпадают.
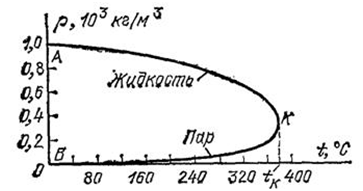
Рис. 1. Зависимость плотности воды и ее насыщенного пара от температуры
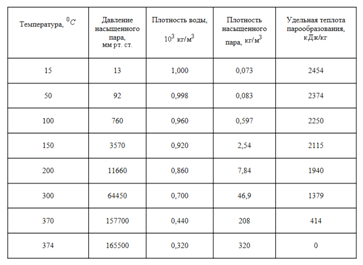
Таблица 1. Свойства воды и ее насыщенного пара при разных температурах
Из таблицы видно, что чем выше температура, тем меньше разница между плотностью жидкости и плотностью ее насыщенного пара. При некоторой температуре (у воды при 374 градусов C) эти плотности совпадают. Температуру, при которой плотности жидкости и ее насыщенного пара совпадают, называют критической температурой данного вещества. На (рис. 1) ей соответствует точка (K). Давление, соответствующее точке K, называют критическим давлением. Критические температуры различных веществ сильно разнятся между собой. Некоторые из них приведены в (табл. 2).
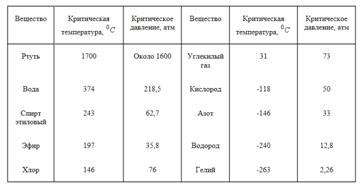
Таблица 2. Критическая температура и критическое давление некоторых веществ
На что указывает существование критической температуры? Что будет при еще более высоких температурах?
Опыт показывает, что при температурах, более высоких, чем критическая, вещество может находиться только в газообразном состоянии. Если мы будем уменьшать объем, занятый паром, при температуре выше критической, то давление пара возрастает, но он не становится насыщенным и продолжает оставаться однородным: как бы велико ни было давление, мы не обнаружим двух состояний, разделенных резкой границей, как это всегда наблюдается при более низких температурах вследствие конденсации пара. Итак, если температура какого-нибудь вещества выше критической, то равновесие вещества в виде жидкости и соприкасающегося с ней пара невозможно ни при каком давлении.
Критическое состояние вещества можно наблюдать при помощи прибора, изображенного на (рис.2). Он состоит из железной коробки с окнами, которую можно нагревать выше (200 градусов C) ( «воздушная баня»), и находящейся внутри бани стеклянной ампулы с эфиром. При нагревании бани мениск в ампуле поднимается, делается более плоским и, наконец, исчезает, что и свидетельствует о переходе через критическое состояние. При охлаждении бани ампула внезапно мутнеет вследствие образования множества мельчайших капелек эфира, после чего эфир собирается в нижней части ампулы.
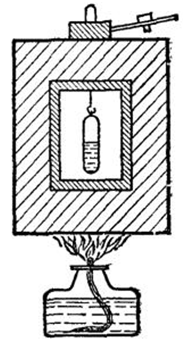
Рис. 2. Прибор для наблюдения критического состояния эфира
Как видно из (табл. 1), по мере приближения к критической точке удельная теплота парообразования становится все меньше и меньше. Это объясняется тем, что при повышении температуры уменьшается различие внутренних энергий вещества в жидком и парообразном состояниях. В самом деле, силы сцепления молекул зависят от расстояний между молекулами. Если плотности жидкости и пара отличаются мало, то мало отличаются и средние расстояния между молекулами. Следовательно, при этом будут мало отличаться и значения потенциальной энергии взаимодействия молекул. Второе слагаемое теплоты парообразования — работа против внешнего давления — тоже уменьшается по мере приближения к критической температуре. Это следует из того, что чем меньше различие в плотностях пара и жидкости, тем меньше расширение, происходящее при испарении, и, значит, тем меньше совершаемая при испарении работа.
На существование критической температуры впервые указал в 1860г. Дмитрий Иванович Менделеев (1834—1907), русский химик, открывший основной закон современной химии — периодический закон химических элементов. Большие заслуги в изучении критической температуры имеет английский химик Томас Эндрюс, произведший обстоятельное исследование поведения углекислоты (CO2) при изотермическом изменении занимаемого ею объема. Эндрюс показал, что при температурах ниже (31 градусов C) в замкнутом сосуде возможно сосуществование углекислоты в жидком и в газообразном состояниях; при температурах выше (31 градусов C) такое сосуществование невозможно и весь сосуд наполнен только газом, как бы ни уменьшать его объем.
После открытия критической температуры стало понятно, почему долго не удавалось превратить в жидкость такие газы, как кислород или водород. Их критическая температура очень низка (табл. 2). Чтобы превратить эти газы в жидкость, их нужно охладить ниже критической температуры. Без этого все попытки их сжижения обречены на неудачу.
Источники:
1. Ландсберг, Г. С. Элементарный учебник физики. Т. 1. Механика. Теплота. Молекулярная физика [Текст] / Г. С. Ландсберг. – М.: Наука, 1985. – 606 c.
• ОТКРЫТИЕ ОБЩЕГО УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Уравнение состояния идеального газа – это формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Это уравнении называется уравнением Клайперона-Менделеева именно потому, что вклад в открытие уравнения внесли оба этих ученых. Если уравнение Клапейрона содержало неуниверсальную газовую постоянную, значение которой необходимо было измерять для каждого газа, то Менделеев нашел коэффициент пропорциональности того, что он назвал универсальной газовой постоянной.
Науке известно четыре вида агрегатных состояний вещества: твердое тело, жидкость, газ, плазма. Переход вещества из одного состояния в другое называют фазовым переходом. Вода, как известно, существует в трех агрегатных состояниях: в жидком (вода), твердом (лед), газообразном (пар). Это различие между тремя агрегатными состояниями определяется межмолекулярным взаимодействием и степенью сближения молекул.
Газ – агрегатное состояние вещества, в котором молекулы движутся хаотически, расположены на большом расстоянии друг от друга. В твердых телах расстояния между частицами малы, сила притяжения соответствует силе отталкивания. Жидкость – агрегатное состояние, промежуточное между твердым и газообразным. В жидкости частицы расположены близко одна к другой и могут перемещаться друг относительно друга; жидкость, как и газ, не имеет определенной формы.
Каждое из этих состояний можно описать набором некоторых параметров: например, состояние газа достаточно полно описывается тремя параметрами: объем, давление, температура.
Комбинация трех параметров, достаточно легко измеряемых, уже с середины ХVII века, когда были созданы барометры и термометры, хорошо описывает состояние газовой системы. Именно поэтому изучение сложных многоатомных систем началось с газов. У истоков наук химии и физики стоял Р. Бойль.
Изучение эмпирических газовых законов (Р. Бойль, Ж. Гей-Люссак) постепенно привело к представлению об идеальном газе, поскольку обнаружилось, что давление данной массы любого газа при постоянной температуре обратно пропорционально объему, занимаемому этим газом, и термические коэффициенты давления и объема с высокой точностью совпадают для различных газов, составляя, по современным данным, 1/273 град–1. Придумав способ графического представления состояния газа в координатах «давление – объем», Б. Клапейрон получил объединенный газовый закон, связывающий все три параметра:
PV = BT,
где коэффициент В зависит от вида газа и его массы.
Только через сорок лет Д. И. Менделеев придал этому уравнению более простой вид, записав его не для массы, а для единицы количества вещества, т. е. 1 кмоля.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона—Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
pVm = RT,
где
• p — давление,
• Vm — молярный объём,
• R — универсальная газовая постоянная
• T — абсолютная температура, К
Так как Vm = V / v, где v — количество вещества, а v = m / M, где m — масса, M — молярная масса, уравнение состояния можно записать:
pV = (m / M)*RT
Эта форма записи носит имя уравнения (закона) Менделеева—Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
pV / T = v R,
pV / T =const
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля—Мариотта, Шарля и Гей-Люссака:
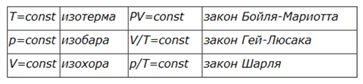
Закон Бойля—Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме:
p = (Y — 1) ре
где Y — показатель адиабаты, е — внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля—Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря нему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство, и произведение P*V немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство, и произведение P*V увеличивается.
Источники:
1. http://ru.wikipedia.org
2. http://coollib.net
• ОТКРЫТИЕ ГЛАВНОЙ ПАЛАТЫ МЕР И ВЕСОВ
Не только выдающимися научными достижениями и открытиями прославил свое имя Дмитрий Иванович. Чрезвычайно разнообразна была его деятельность и в области развития русской промышленности. Знание и дело, теория и практика, наука и промышленность были для него нераздельны. «Наука и промышленность, вот — мои мечты», эти строки из его завещания к детям ярко характеризуют основную направленность его многосторонней, высоко плодотворной деятельности. В значительной мере именно потому, что в предложенной ему (после ухода из университета) работе в Главной Палате мер и весов «чистая наука тесно переплелась с практикой», Дмитрий Иванович дал свое согласие возглавить эту работу. Ей он посвятил последние 15 лет своей жизни. В своих классических исследованиях, выполненных в Главной Палате ( «Опытное исследование колебания весов», «О приемах точных или метрологических взвешиваний», «Ход работ по возобновлению прототипов» и др.), он устанавливает основы метрологии как специальной научной дисциплины, изучающей проблемы высокоточного измерения.

Измерительное дело в нашем отечестве, как и в других странах, развивалось в тесной связи с потребностями хозяйственной жизни. В течение долгого времени наибольшее значение имели измерения при помощи торговых мер и весов. В этой области уже издавна делались попытки узаконить единицы измерения и установить контроль правильного применения мер и весов, за отсутствием злоупотреблений. В древней Руси обязанности контроля выполняло духовенство, позднее они перешли к «приказам» Московского государства. В дальнейшем правительством был издан ряд постановлений, направленных на упорядочение измерительного дела в стране. В 1736—1742 гг. специальная комиссия изготовила образцовый русский фунт (золоченный, бронзовый) и определила нормальную величину аршина, а в 1747 г. было предписано делать аршины во всей стране в соответствии с этой величиной.
В 1827 г. была создана Комиссия по мерам и весам, которая изготовила образцы сажени и фунта из платины и установила переводные коэффициенты для сравнения русских и иностранных мер. Для хранения изготовленных «образцов» намечено было построить специальное здание и организовать Депо образцовых мер и весов, начавшее свою работу в 1842 г. под руководством академика А. Я. Купфера (1799—1865).
Работа, выполненная Комиссией, легла в основу «Положения о весах и мерах» от 4 июня 1842 г. Этим Положением, введенным в действие с 1 января 1845 г., были установлены основы государственной службы мер и Весов в России, на базе установления единых мер, создания прототипов (первичных образцов) мер длины и массы и организации центрального метрологического учреждения — Депо образцовых мер и весов. Вскоре, однако, выяснилось, что Депо образцовых мер и весов не отвечает полностью тем требованиям, которые предъявлялись к измерительному делу хозяйством страны. Настоятельно ощущалась необходимость в дальнейших преобразованиях. В связи с этим в 1892 г. Д. И. Менделееву было предложено возглавить поверочное дело в России и поставить его на должную высоту. В 1893 г. Депо, функции которого сводились, главным образом, к хранению прототипов и поверке основных копий, по настоянию Д. И. Менделеева было переименовано в Главную Палату мер и весов. Этим названием подчеркивался переход учреждения к активной деятельности в государственном масштабе. Д. И. Менделеев получил звание управляющего Палатой.
Реорганизацию измерительного дела в России Д. И. Менделеев начал с изготовления новых, образцовых, в смысле точности, прототипов мер длины и массы (веса), поскольку многие обстоятельства вызывали сомнение в неизменности прежних прототипов. Основная задача государственной службы мер и весов заключается в поддержании измерительного хозяйства страны на достаточно высоком уровне в смысле правильности и единообразия мер и измерительных приборов, для чего те и другие (в первую очередь, торговые меры и весы) должны сличаться с образцовыми, а последние с основными эталонами, но не непосредственно, а через ряд промежуточных ступеней (копии эталонов, рабочие эталоны), причем сами образцовые меры подразделяются на разряды в зависимости от степени точности. Поэтому неточности в измерениях или изготовлении промежуточных образцов при последовательном сличении будут суммироваться и в результате могут выразиться значительной величиной. Этим обуславливается «погоня за всей возможной точностью» (по выражению Д. И. Менделеева) при изготовлении прототипов, от которых зависят все прочие меры. Особенно большое значение точность прототипов имеет для научных исследований, а также для точных измерений в промышленности и для упорядочения торговых сношений.
В качестве прототипов мер длины и массы Д. И. Менделеев остановился на аршине и фунте. Материалом для изготовления этих прототипов был избран платиноиридиевый сплав. О том, насколько сложно изготовление прототипов высокой точности, можно судить по словам самого Д. И. Менделеева (об изготовлении фунта и других гирь в качестве «вторичных прототипов»): «К апрелю 1894 г. в первой грубой отделке прототипы были готовы, после чего следовало: а) придать им обтачиванием и шлифовкою надлежащую форму и размер; б) отполировать их поверхность, чтобы малейшее постороннее тело и всякие слабые знаки на ней были ясно видны; в) нанести знаки, отличающие отдельные экземпляры прототипов, но столь слабые, чтобы в их углубления не могла осаждаться пыль; г) определить их удельный вес и объем при обыкновенных температурах; д) довести вес приближенно до желаемого, не нарушая полировки; е) произвести полное сличение с нормой, чтобы окончательно определить малый перевес; ж) снять этот перевес, т. е. привести к окончательному весу; з) сличить вес с нормою через ряд повторенных точных взвешиваний; и) произвести такое же сличение со всеми иными экземплярами и копиями, в нашем случае — фунта; к) выверить все подразделения основной единицы веса (фунта), чтобы можно было выразить все разности в тех же единицах, и л) произвести сравнение с другими прототипами, в нашем случае с английским фунтом, килограммом и с граммами».

Каждая из этих операций должна была производиться над прототипами только после многих проб на специальных моделях. Несмотря на все трудности, изготовление новых прототипов было выполнено необычайно скоро, а именно в 6 лет (1893—1899 гг.), в то время как в Англии аналогичная работа продолжалась 21 год (1834—1855), а во Франции 17 лет (1872—1889). Работа была выполнена с исключительной точностью.
Новый прототип длины при 16,667 градусов С оказался отличным от 28 дюймов лишь на 3,7 микрона, а усовершенствование техники точных взвешиваний Д. И. Менделеевым дало возможность установить, что вес нового прототипа фунта заключается в пределах 409,51240—409,51241 г. Для облегчения сравнения русских мер длины с иностранными с целью последующего перехода на метрическую систему мер (применение которой было допущено «Положением о весах и мерах» от 4 июня 1899 г.) Д. И. Менделеев изготовил прототип полусажени, на котором была сначала нанесена точная длина английского ярда (по английскому прототипу), а затем — метра и аршина (с подразделением на дюймы, сантиметры и вершки).
Параллельно с изготовлением прототипов (и частично даже ранее) Д. И. Менделеев выполнил большую работу по усовершенствованию и исследованию весов, которые он считал «образцовым и точнейшим прибором естествоиспытателей». Он улучшил конструкцию весов и принял специальные меры для достижения постоянства температуры в весовой комнате и для устранения всякого влияния посторонних факторов. При наблюдениях лицо, их выполнявшее, находилось вдали от весов, а сами наблюдения и перемена груза на чашках весов и наложение добавочного веса производились издали. При взвешивании учитывалась необходимость самых различных поправок — на приведение к пустоте, на гигроскопичность, стирание поверхности и пр. Дмитрий Иванович в совершенстве разработал методику точных взвешиваний и обработки результатов измерений, значительно опередив в этом отношении метрологические институты других стран и даже Международное бюро мер и весов. Точность единичного взвешивания он довел до сотых долей миллиграмма.
Для повышения точности взвешиваний весьма важно знать точные значения физических констант, в первую очередь — веса литра воздуха и литра воды. Знать точный вес одного литра воздуха необходимо для внесения поправок на вес вытесняемого гирями воздуха, а вес литра воды — для определения соотношения между единицами веса и мерами объема. В результате тщательного анализа работ предыдущих исследователей Д. И. Менделеев установил значение этих констант с весьма большой точностью. В последние годы своей жизни Д. И. Менделеев начал работать над созданием установки для абсолютного определения третьей физической константы — напряжения силы тяжести. Здесь его таланты экспериментатора, метролога и конструктора выявились особенно ярко. Задуманная им измерительная установка представляла грандиозное сооружение, главной частью которого служила железная труба, углубленная в землю на 16,5 м; эта труба позволяла использовать маятники длиной до 38 м. Вторая труба, высотой 4 м, предназначалась для наблюдений над маятниками меньшей длины (4 м и 0,5 м). Работа маятников предполагалась в разреженном пространстве и в различных газах. Дмитрий Иванович разработал проект установки во всех деталях, но не успел довести ее до конца. Эта колоссальная установка была закончена после его смерти его преемниками.
Д. И. Менделеев провел в Главной Палате ряд важных организационных мероприятий. Им были созданы лаборатории мер длины и массы (веса), электроизмерительная, термометрическая, манометрическая и др. Главная палата мер и весов превратилась в первоклассное метрологическое учреждение, ставшее в один ряд с лучшими аналогичными метрологическими учреждениями Запада. Тем самым Дмитрий Иванович высоко поднял авторитет русского имени за границей (в области высокоточных измерений) и значительно способствовал росту доверия к русским мерам и расширению торговых сношений.
По инициативе Дмитрия Ивановича были созданы на территории России в различных местах поверочные палатки, которые подчинялись непосредственно Главной Палате. Число палаток дошло к концу его жизни до 25. Точно так же по идее Дмитрия Ивановича был устроен передвижной вагон-палатка, предназначенный для обслуживания местностей, расположенных вдали от стационарных палаток. Им был создан штат разъездных инспекторов, периодически производивших ревизии в различных городах России. Наконец, Дмитрию Ивановичу принадлежит заслуга создания кадров русских метрологов. Под его руководством проходили школу точных измерений сотрудники лабораторий Главной Палаты и разъездные инспекторы. Была создана специальность государственных поверителей. Штат Депо образцовых мер и весов состоял только из трех человек, число же сотрудников Главной Палаты в конце исчислялось уже сотнями поверителей, которые приобрели необходимые специальные познания под руководством сотрудников Д. И. Менделеева и сдавали установленные испытания при Главной Палате.

Положительные результаты реорганизации службы мер и весов начали быстро сказываться. Единообразие, определенность и строгость требований Главной Палаты, неуклонно проводившихся в жизнь при помощи поверочных палаток, и высокая квалификация их сотрудников повлекли за собой уменьшение числа неправильных мер и весов в стране, а технические консультации, проводившиеся на местах опытными сотрудниками Главной Палаты по указаниям Д. И. Менделеева, способствовали повышению качества изготовляемых приборов.
После смерти Д. И. Менделеева деятельность Главной Палаты успешно развивалась год, руководством возглавлявших ее таких выдающихся отечественных ученых, как проф, Н. Г. Егоров (1907—1919), проф.Ф. И. Блумбах (1919—1921), акад. Д. П. Коновалов (1922— 1929) и проф. М. А. Шателев (1929—1931). В 1939 г. полномочия государственной службы мер и весов были значительно расширены, и Главная Палата была преобразована в Комитет по делам мер и измерительных приборов при СНК СССР. Комитет обратил особенное внимание на создание новых эталонов, усовершенствование методики точных измерений, расширение номенклатуры поверяемых приборов, надзор за увеличением количества и повышением качества продукции приборостроительных предприятий и пр.
Такова в кратких чертах история развития в нашей стране службы мер и весов, получившей прочный фундамент благодаря деятельности великого русского ученого.
Источники:
1. http://azbukivedi-istoria.ru